2023年6月,国家血液系统疾病临床医学研究中心、苏州大学附属第一医院、造血干细胞移植研究所的吴德沛、徐杨、储剑虹教授团队在Nature Communications期刊上在线发表了题为“Chimeric antigen receptor T cells targeting FcRH5 provide robust tumour-specific responses in murine xenograft models of multiple myeloma”的研究论文,报道了靶向FcRH5的CAR-T细胞在体外和小鼠异种移植模型中具有强力的清除多发性骨髓瘤(MM)细胞的能力,揭示FcRH5可作为CAR-T疗法治疗复发难治性MM的全新靶点。

嵌合抗原受体修饰的T细胞(CAR-T)疗法是近年来新兴的细胞免疫治疗手段。尽管靶向BCMA的CAR-T疗法在治疗复发难治性MM中取得了重要的突破,但仍有约60%的患者面临复发。BCMA在很多MM患者的肿瘤细胞表面不表达或者仅微弱表达,以及BCMA蛋白在γ-secretase的作用下从MM细胞表面脱落变为可溶性BCMA等都会影响BCMA CAR-T治疗MM的疗效,因此亟需探索安全有效的CAR-T治疗新靶点。
本研究从苏州大学附属第一医院血液科收集到28例MM样本进行分析并发现:有22例患者(78.57%)MM细胞上FcRH5表达百分比大于50%,BCMA为10例(35.71%),在大多数患者中FcRH5表达阳性率及平均荧光强度比值高于BCMA,且鉴别出部分患者MM细胞BCMA表达缺失却高表达FcRH5。此外,本研究还发现MM高风险型染色体1q21变异的MM患者FcRH5表达水平显著增高。

本研究开发出靶向FcRH5的 CAR-T并通过体外实验证实FcRH5 CAR-T能够高效识别和杀伤MM细胞株和MM患者自体的原代肿瘤细胞并迅速增殖以及分泌大量细胞因子;且FcRH5 CAR-T对肿瘤细胞的识别和杀伤效应具有抗原依赖性。在局灶性和播散性MM的异种移植小鼠模型中,输注FcRH5 CAR-T或BCMA CAR-T均能有效清除小鼠体内肿瘤,延长小鼠生存时间,且两种CAR-T的治疗效果相当。另外,FcRH5 CAR-T能在体内外有效识别和杀伤BCMA基因敲除的MM细胞株,而后者完全丧失了对BCMA CAR-T的反应性。
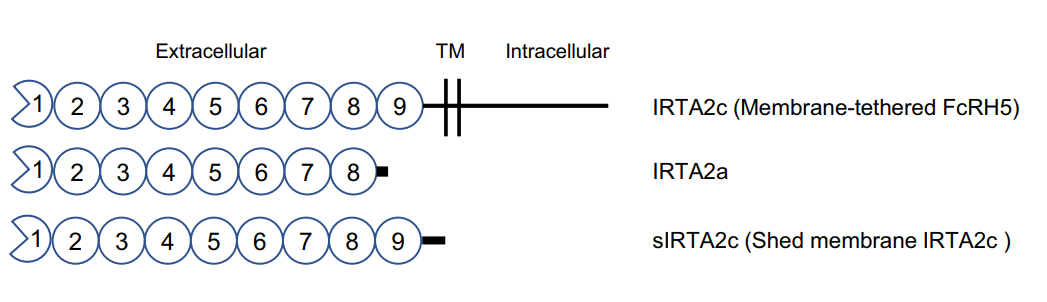
文献报道在MM患者的外周血中也存在大量的可溶性FcRH5蛋白(sFcRH5),其可能以两种存在形式:一种是基因的选择性剪切形成的分泌型产物IRTA2a,另一种为FcRH5蛋白经由细胞蛋白酶切割形成的sIRTAT2c。目前的研究结果支持IRTA2a是sFcRH5最主要的存在形式,而sIRTAT2c仅占很少部分甚至几乎不存在。本研究发现重组IRTA2a蛋白不能被FcRH5 CAR-T细胞识别,且不影响后者的效应功能;而重组sIRTA2c蛋白可直接结合并刺激FcRH5 CAR-T细胞产生大量的IFN-γ,并能减弱FcRH5 CAR-T对靶细胞的杀伤作用。有意思的是,sIRTA2c蛋白发挥的这种影响可以通过提升效/靶比或者延长共培养时间来弱化,后者提示这种影响只是短暂性的存在。
在安全性方面,本研究发现FcRH5在正常组织细胞中的表达仅限于小部分B细胞,且FcRH5 CAR-T细胞对正常B细胞仅有微弱的杀伤效应;另外也展示了在CAR结构中引入icaspase-9自杀基因以提升FcRH5 CAR-T的安全性的可行性。
目前CAR-T疗法克服抗原逃逸的主要策略是设计开发同时靶向两种肿瘤抗原的双特异性CAR-T。本研究通过串联靶向BCMA和FcRH5的scFv制备出FcRH5-BCMA CAR-T及BCMA-FcRH5 CAR-T这两种双特异性CAR-T。体外实验表明:只有FcRH5-BCMA CAR-T具备对两种靶点蛋白的识别反应能力。在体外实验以及荷瘤小鼠模型中:FcRH5-BCMA双特异性CAR-T的抗MM活性优于BCMA CAR-T或者FcRH5 CAR-T。
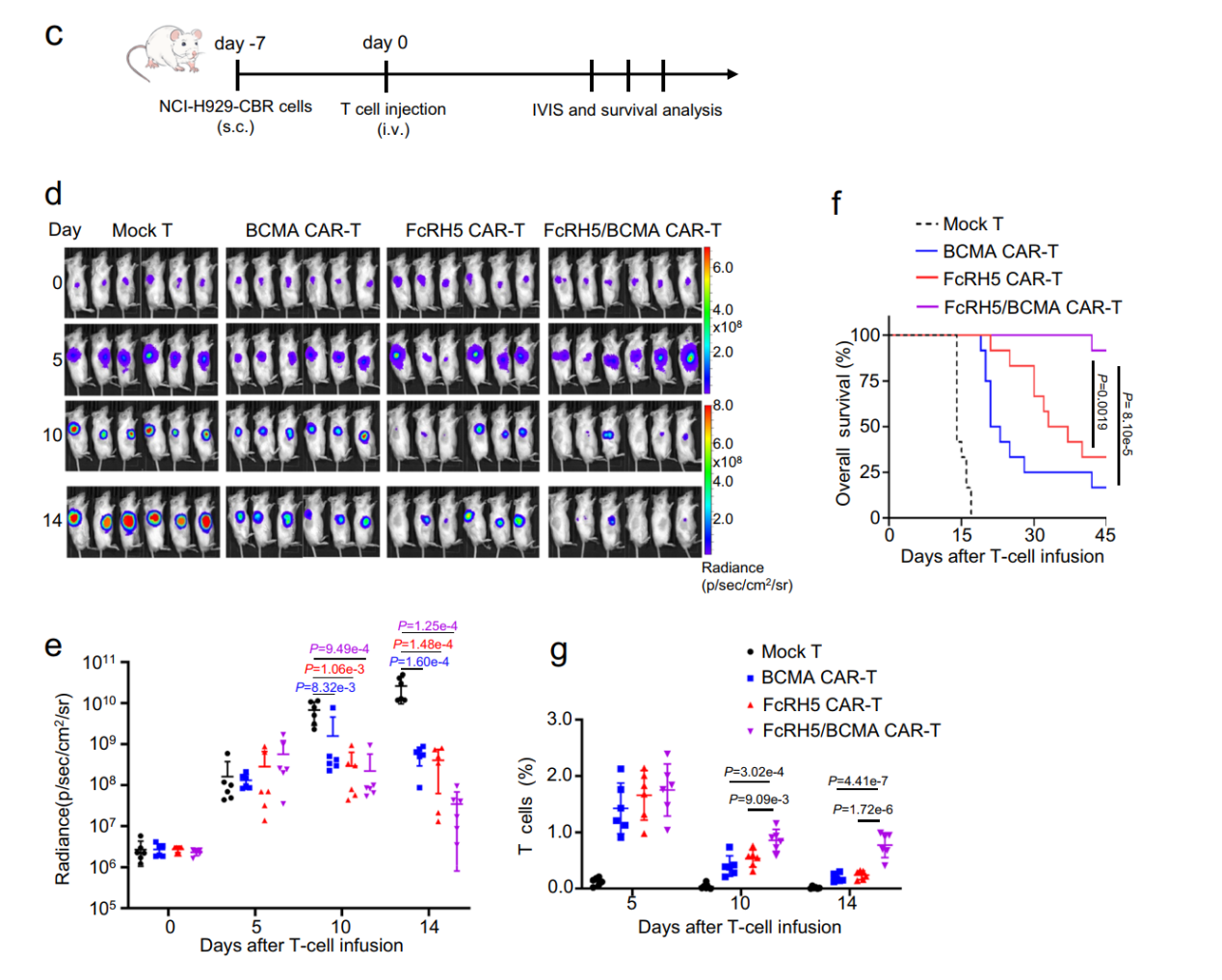
该临床前研究从多方面支持FcRH5作为CAR-T疗法治疗MM的新靶点具有较好的有效性和安全性。该成果的成功临床转化有望为复发难治性MM患者(包括BCMA本身低表达以及靶向BCMA疗法治疗无效的患者)提供一种全新的治疗策略。
国家血液系统疾病临床医学研究中心、苏州大学附属第一医院、苏州大学造血干细胞移植研究所的吴德沛教授、徐杨教授和储剑虹教授为本文的共同通讯作者。该研究得到国家自然科学基金委、科技部重点研发计划、国家血液系统疾病临床医学研究中心、江苏省科技厅等多个科研资金的支持。蒋东鹏、黄海雯、秦慧敏为本文的共同第一作者。
原文摘要:BCMA-targeting chimeric antigen receptor (CAR) T cell therapy demonstrates impressive clinical response in multiple myeloma (MM). However, some patients with BCMA-deficient tumours cannot benefit from this therapy, and others can experience BCMA antigen loss leading to relapse, thus necessitating the identification of additional CAR-T targets. Here, we show that FcRH5 is expressed on multiple myeloma cells and can be targeted with CAR-T cells. FcRH5 CAR-T cells elicited antigen-specific activation, cytokine secretion and cytotoxicity against MM cells. Moreover, FcRH5 CAR-T cells exhibited robust tumoricidal efficacy in murine xenograft models, including one deficient in BCMA expression. We also show that different forms of soluble FcRH5 can interfere with the efficacy of FcRH5 CAR-T cells. Lastly, FcRH5/BCMA-bispecific CAR-T cells efficiently recognized MM cells expressing FcRH5 and/or BCMA and displayed improved efficacy, compared with mono-specific CAR-T cells in vivo. These findings suggest that targeting FcRH5 with CAR-T cells may represent a promising therapeutic avenue for MM.
原文链接:https://www.nature.com/articles/s41467-023-39395-4#article-comments
(造血干细胞移植研究所供稿)


