苏州大学附属第一医院呼吸与危重症医学科黄建安教授与刘泽毅研究员团队在肺癌机制研究与靶向治疗领域连续取得重大突破,多项高水平研究成果相继发表于国际权威期刊,系统揭示了肺癌进展的关键分子机制并提出创新性治疗策略,充分体现了该团队在肺癌基础与转化研究方面的重要影响力。
近期,该团队于国际知名期刊Cancer Research(IF = 16.6)上发表题为“Targeting ATP7A-Dependent Copper Metabolic Homeostasis Induces Cuproptosis and Suppresses the Progression of Mutant KRAS-Driven Lung Cancer”的重要论文。该研究首次揭示了铜离子载体Elesclomol(ES)可通过诱导内质网应激-OSTM1轴,促进铜转运蛋白ATP7A的泛素化降解,破坏KRAS突变型肺腺癌细胞的铜代谢稳态,进而诱发铜死亡(Cuproptosis),显著抑制肿瘤进展。这一发现为长期以来缺乏有效靶向治疗方案的KRAS突变肺癌患者提供了全新的治疗思路和实验依据,具有重要的临床转化前景。

值得注意的是,该研究不仅从临床样本中发现肺腺癌患者血清及胸腔积液中铜水平与肿瘤增殖显著相关,还通过构建条件性KRASG12D突变小鼠模型及类器官模型,在体内外水平验证了ES联合铜处理的抗肿瘤效果,并阐明其分子机制依赖于OSTM1介导的ATP7A蛋白降解通路。研究首次建立“铜代谢—内质网应激—OSTM1—ATP7A”调控轴,深化了对铜死亡生物学过程的理解,也为跨越KRAS突变亚型限制及解决耐药问题提供了潜在策略。
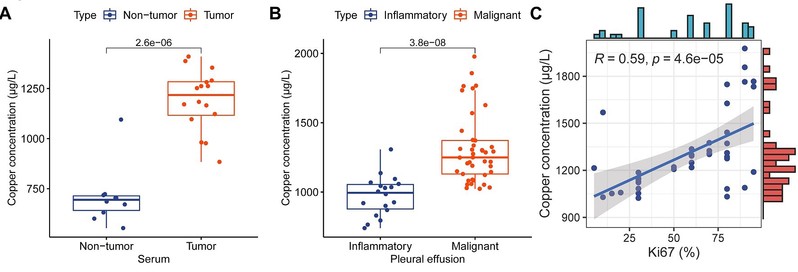
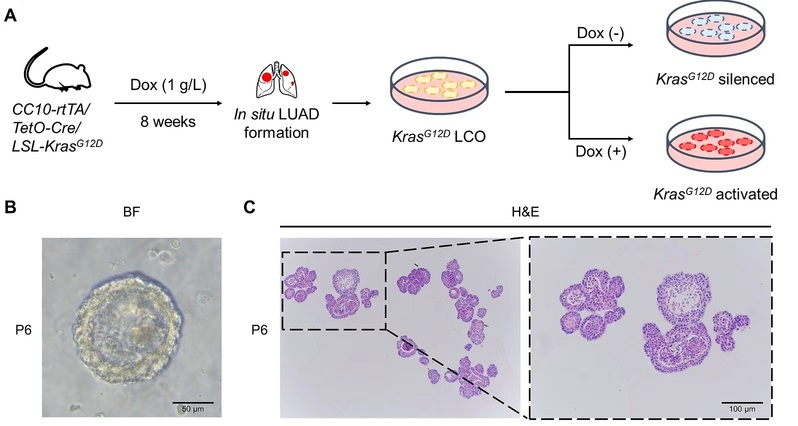
图2. KRASG12D条件突变小鼠及KRASG12D突变类器官模型的构建
此外,该团队前期于PNAS期刊上发表的另一项研究,系统阐释了CD73作为新型配体直接激活Axl/Smad3信号通路、促进非小细胞肺癌转移的非经典机制。这项研究不仅揭示CD73与Axl在肺癌组织中的表达呈正相关,还发现其作用方式在肺腺癌和肺鳞癌中存在差异,强调了靶向CD73在抑制肺癌转移中的潜在价值。

这两项研究虽着眼点不同,前者聚焦于新型细胞死亡机制与治疗策略开发,后者侧重于肿瘤转移的分子基础,共同体现了黄建安/刘泽毅团队在肺癌生物学领域的深厚积累和多维度科研能力。他们从临床问题出发,融合前沿模型技术与分子机制探索,致力于揭示肺癌发生发展的核心通路,并为改善肺癌患者预后提供理论依据和干预策略。目前,团队正进一步推进相关研究成果的临床转化工作,未来有望为肺癌患者带来新的治疗希望。
该研究得到国家自然科学基金、江苏省医学重点学科、江苏省333高层次人才培养工程、苏州市基础研究计划等多项基金资助。
原文链接:
https://doi.org/10.1158/0008-5472.CAN-24-2558
https://doi.org/10.1073/pnas.2404709121


